医疗器械对于创业者来说还是一片蓝海,但是你不要把它当做智能硬件 -凯发k8网页登录

数字移动医疗是目前的热点之一,也是不少医疗药品健康领域内人士创业的首选。相比医疗服务与医药,医疗器械其实是创业的一个不错选择。医疗服务目前还需要同公立医院进行反复艰苦的博弈,药品销售的牌照仍然是创业者头上的一把利剑。
医疗器械是创业者蓝海
首先,相对于药品来说,医疗器械的研发及报批周期缩短很多。现在通常一个新药从研发到上市需要大约10年时间。仿制药研发时间短,但报批不容易。器械中,三类是最难的,但相比药品,依然可以快很多。不同种类的医疗器械拿到注册证的时间相差很大,一般来说,3-5年左右。如果属于创新类器械,报批速度将更快。
其次,医疗器械相对于药品的研发失败率低很多。目前药品方面研发失败的消息不断,许多跨国大型药厂开始联合开发,抱团取暖,以降低研发失败的影响。
由于药品主要通过化学、生物、免疫或代谢等方式发挥作用,而药品进入人体后触发的一系列反应依然有很多未知和不可控,这些因素都将影响产品最终研发的结果。医疗器械大多是通过物理方式发挥作用,虽然目前器械 药物、器械 生物制品也是研发热点,但相对于整体医疗器械来说,这些比重较小。器械大体上可控,并且一直到临床验证阶段,依然可以不断改进产品设计,因此总体上研发失败率比药品低得多。
最后,医疗器械是一个非常广阔的领域,从诊断试剂,到大型影像设备,到植入性器械、光学、齿科、监护、康复……领域之广,是我国目前医疗器械远远还未覆盖到的。根据《2013中国医疗器械行业发展状况蓝皮书》,自2001年至2012年,中国医疗器械市场销售规模由179亿元增长到1700亿元,剔除物价因素影响,12年间增长了近9.4倍。在全球市场,器械和药品的消费额比例大约为1:1,而我国的医疗器械消费仅占到药品的约14%,说明医疗器械的发展还有巨大的空间,远未达到天花板。
同时,我国的医疗器械依然处于充分竞争阶段,目前尚未有占据绝对主导地位的公司,即垄断还未出现,这同样给了创业型公司发展的空间。
随着信息技术的高速发展,各种新产品更是层出不穷,其中智能可穿戴设备与健康追踪设备集中爆发,也带来了一个接地气的疑问,我们如何分辨医疗类器械?
目前常见的数字移动医疗类产品大多以管理和交流为出发点,有帮助慢性病记录及管理的app,用于辅助诊断、治疗及用药等信息处理的智能软件,医院的电子病案,网上咨询/问诊系统,病友互助交流社区,智能可穿戴设备以及数据处理平台等等,目标集中在医患,但也越来越趋向于对健康管理有需求的大众用户。
医疗器械的定义
这些产品是否属于医疗器械?根据2014年6月1日生效的《医疗器械监督管理条例》(国务院令第650号),医疗器械是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是:
疾病的诊断、预防、监护、治疗或者缓解;
损伤的诊断、监护、治疗、缓解或者功能补偿;
生理结构或者生理过程的检验、替代、调节或者支持;
生命的支持或者维持;
妊娠控制;
通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
对比2000年4月1日生效的《医疗器械监督管理条例》(国务院令第276号),可以发现医疗器械的范围扩大了,不再局限于传统的预防、诊断和治疗,而是扩大到以医疗为目的的直接或间接作用于人体的各种物品。
根据医疗器械的定义,如果前述的数字医疗产品直接或间接接触人体,对人体样本进行检查,将归属于医疗器械。
比方说可穿戴产品中,有收集人体血压、心率、血糖等指标,是医疗器械;如果只是帮你计算运动量、打电话、播放mp3,则不属于医疗器械。对于辅助疾病管理的app和软件,如果只是储存和处理输入的数据(非直接从人体或人体样本获得),不属于医疗器械;但如果处理的数据直接来自于人体或人体样本,则是医疗器械。对于某些间接收集的数据,如果参与诊断过程也会被视为医疗器械,比如一些公司的ct/pet数据处理工作站,但如果只是存储备份传输就不算。
国家对医疗器械按照风险程度实行分类管理:第一类是指风险程度低,实行常规管理可以保证其安全、有效的医疗器械;第二类是指具有中度风险,需要严格管理以保证其安全、有效的医疗器械;第三类是指具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械。
根据2014年10月1日生效的《医疗器械注册管理办法》(国家食品药品监督管理总局局令第4号),第一类医疗器械实行备案管理,第二类、第三类医
疗器械实行注册管理。通常来说,第三类医疗器械由于风险较高,经常需要临床试验的数据来支持注册;第一类较简单,备案即可;第二类医疗器械,根据《医疗器械临床评价技术指导原则(征求意见稿)》,需要收集相关的数据对产品进行论证。如果现有数据就能明确证明产品的有效性和安全性,可以不必做临床试验,反之则需要临床试验的数据来支持产品的有效性和安全性。
评估海外市场潜力
对于医疗器械风险程度的评价,主要考虑医疗器械的预期目的、结构特征、使用方法等因素。美国fda采取类似的风险评估和管理方法,如下图:
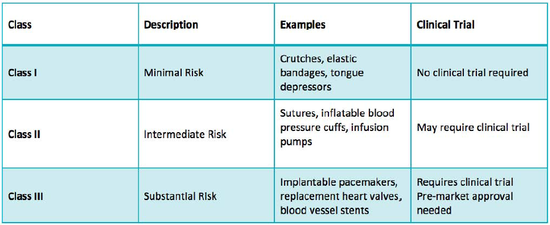
如果实在不知道自己的产品属于哪一类,可以在fda的网站上递交申请,fda会协助判断产品的类别,当然,这是要收费的。cfda也可以对不明分类的产品进行分类界定,目前是免费的,就是时间比较长,半年左右。
如果选择创业,了解一些医疗器械方面的法规要求会对创业者有以下帮助:
了解法规的准入规则可更准确的规划产品的生命周期,市场定位和目标群体。如果产品属于医疗器械,在早期做商业计划时,可以根据产品申报和注册的时间,推算拿到注册证的大致日期;根据时间线,可预估产品的生命周期,决定后续的计划。由于数字移动产品发展很快,早几个月或者晚几个月拿到注册证,有可能市场定位和目标客户会相差非常大。
遵循通行的产品标准,避免潜在风险,同时为将来发展预留足够的空间。医疗器械的注册、标签、生产和经营管理有法规的强制性要求。一旦被发现不符合法规要求,处罚将是非常严厉的。因此,了解这些规定,有助于避免风险。此外,医疗器械行业还有各种行业标准。移动医疗产品,基本都是有源产品,对此全球有很多行业标准可以参照。符合这些标准的好处是,一旦将来往外推广,产品可以适应各种体系和检测。
扩大规模时,提供新的思路和出路。当产品准备出口时,法规尤其重要。各国对医疗器械的监管力度是不一样的,相对来说,在欧盟拿到上市许可(ce)比在美国(pma)容易,可能也比中国容易。中国目前处于充分竞争阶段,大量类似和雷同产品的小公司在国内市场竞争。这种情况下,对于某些比较特殊的医疗器械,转到海外市场,也许是另一种思路和出路。
由于现在数字化进程太快,数字医疗相关的法规和监管来不及更新,没有太多条条框框约束,反而给了创新者更多的发挥空间。互联网技术进入医疗领域,或许是创新的开始。
以上简单介绍了与数字移动医疗产品相关的一些法规,希望能给创业者带来一点启发或提供一点思路,也欢迎探讨和指正。
本文作者是amber,从事医疗器械临床研究工作,关注医疗行业政策和法规。联系邮箱:ambber@163.com,微博:旅途与修行

相关阅读
- 14类耗材,最低价联动2024-11-27
- 新一轮高值耗材集采或将启动2024-03-12
- 二三类医疗器械实名制,再扩围!2023-07-27
- 国家六部门发文,全国下半年带量采购方向定了!2023-07-26
- 当国产器械玩起「高端局」2023-05-26






