三部门发文,医疗器械「实名制」扩围! -凯发k8网页登录
第二类医疗器械udi铺开,生产、流通、使用环节走向全流程闭环管理,器械监管新生态正在生成。
01医疗器械「身份证」,全链条覆盖
近日,北京市药监局、北京市卫健委、北京市医保局发布《关于做好第三批实施医疗器械唯一标识工作的通知》(以下简称《通知》),北京市药监局还制定印发了《北京市医疗器械注册人备案人唯一标识实施指南》《北京市医疗器械经营企业唯一标识实施指南》《北京市医疗机构医疗器械唯一标识实施指南》。


三份“指南”分别对注册人、备案人、经营企业、医疗机构多个环节的udi覆盖工作提供了指导建议。
主要内容包括建立健全医疗器械唯一标识实施团队、制度体系建设、具体实施步骤、实施流程图等,为各单位开展实施应用工作提供参考,确保医疗器械唯一标识实施应用全程可控、提质增效。
北京市药监局提出,将加快组织推进医疗器械唯一标识制度建设,加强注册生产流通使用各环节制度研究和推广应用,促进医疗器械精准化管理,形成从源头注册生产到最终临床使用全链条联动,提高监管效能和社会治理能力。
根据上述公告,北京市药监局进一步明确,执行第三批医疗器械唯一标识要求,同时“鼓励其他第二类医疗器械实施唯一标识”。
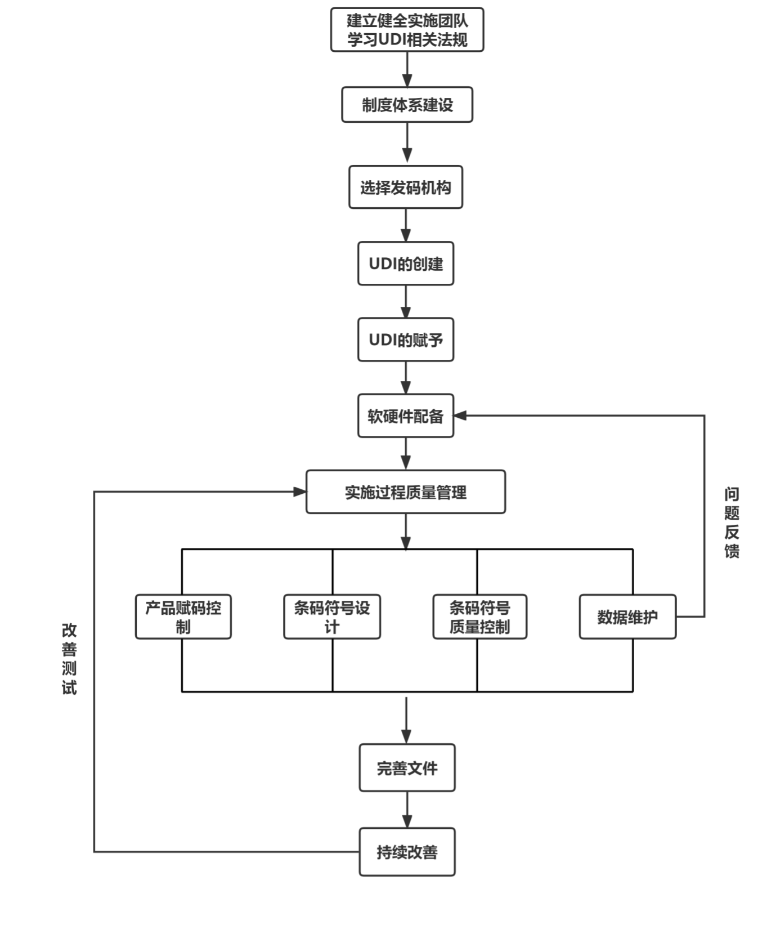
(截图自《北京市医疗器械注册人备案人医疗器械唯一标识实施指南》)
今年2月,国家药监局、国家卫健委、国家医保局发布《关于做好第三批实施医疗器械唯一标识工作的公告》,其中明确,按照风险程度和监管需要,确定部分临床需求量较大的一次性使用产品、集中带量采购中选产品、医疗美容相关产品等部分第二类医疗器械作为第三批医疗器械唯一标识实施品种。
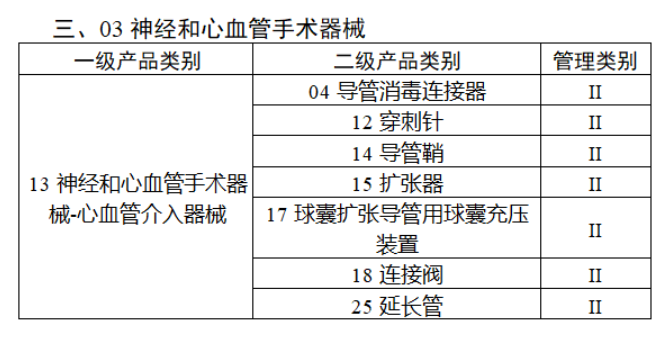
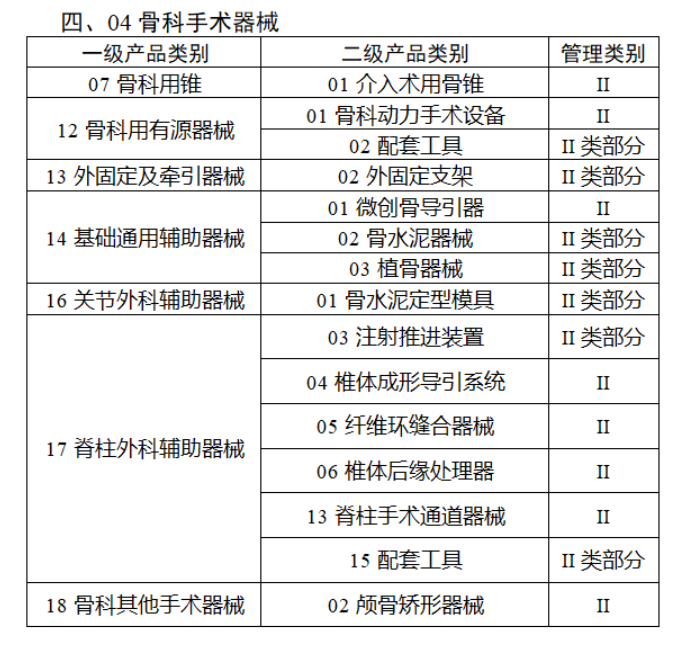
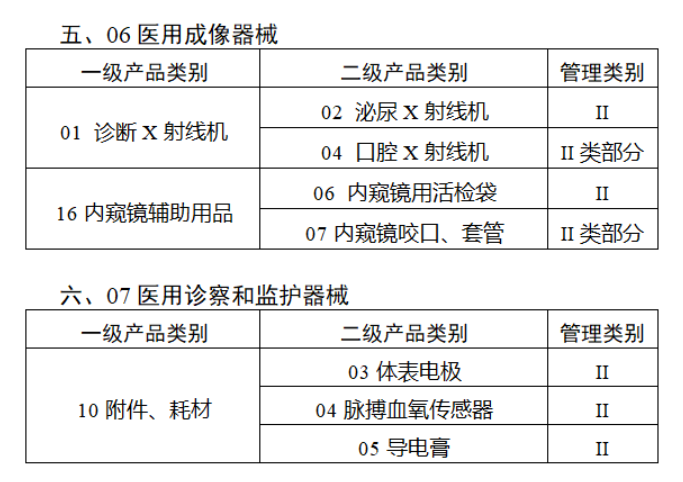
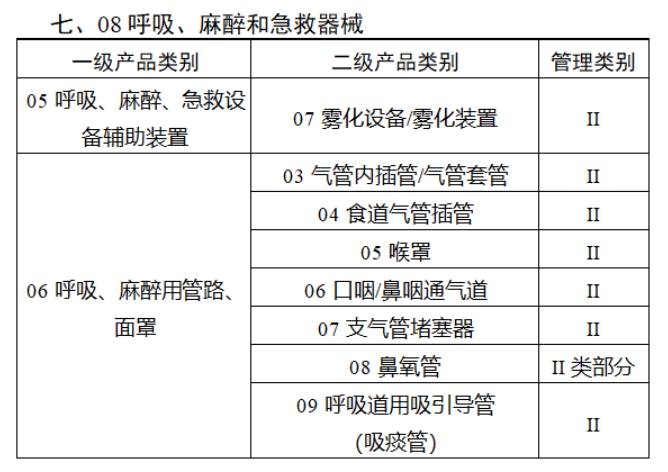
第三批医疗器械唯一标识实施品种共包括103种二类医疗器械,有超声手术设备、激光手术设备及附件、高频/射频手术设备及附件、内窥镜手术用有源设备、神经和心血管手术器械-心血管介入器械、骨科手术器械、诊断x射线机、光治疗设备、起搏系统分析设备、注射泵、临床检验器械等。
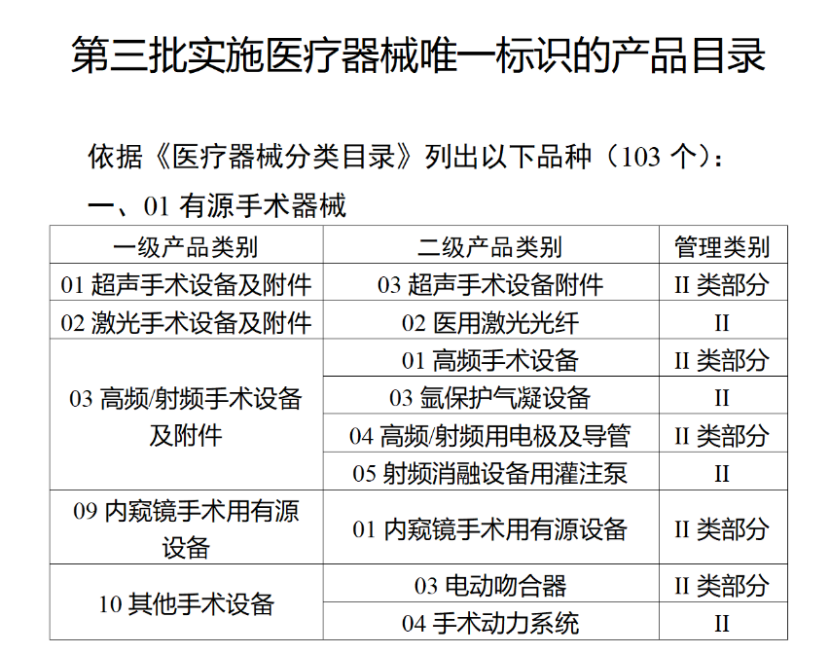
(完整清单附文末)
生产、流通、使用环节实现udi全覆盖后,全流程闭环管理也将实现,医疗器械监管将进一步革新。
02「实名制」管理,企业自驱力如何?
事实上,早在全国第三批医疗器械唯一标识正式启动之前,二类医疗器械udi编码已经悄然开始了。
在发码机构工作的陈振对赛柏蓝器械谈到,目前很多企业正在推进二类医疗器械的udi工作,一些企业早在去年就开始推进二类医疗器械的唯一标识。
尽早推进第二类医疗器械唯一标识工作,企业有自己的考量。
陈振谈到,医院要求产品在进入到医院体系的时候,必须要有udi编码和标签。每个省市也会有不同的要求,一些省份去年就开始推动二类医疗器械udi了。
据赛柏蓝器械观察,2022年,海南、福建、四川、北京、天津等多省市,陆续发布了有关二类医疗器械唯一标识工作的文件。
“udi是一个大趋势,很多企业会自驱地向前推动唯一标识工作。通过编码去实现内部的一些管控,比如说像防串货、追溯或者说发货、防伪等等,都可以通过udi编码去做。”
“以往企业采用序列号,但由于每个企业的sn号规则不统一,流通到下游的时候,常常无法通过sn号解析相应的信息。另外在流通环节缺乏有效约束,通过sn号做防伪或者防串,可能会出现被撕掉的情况。”
对于器械企业而言,转变也并非一蹴而就。
业内人士周军表示,企业要完善自己udi的信息系统、管理系统,要做到内外顺畅的衔接,这个是需要投入资源的。包括软硬件的升级还有内部统一协调等,要建立内部的协调机制,要有管理制度和管理规则,需要投入精力和成本。
“唯一标识是从生产源头开始对医疗器械进行管理,生产企业相关注册证必须要在规定时间内完成udi的编码,然后申报录入信息系统。而在医院端,尤其是大三甲医院,要求企业提供唯一标识,终端需求也会提高企业动力。”
03udi覆盖,需各环节联动配合
按照国家药监局进度安排,2024年6月1日起生产的医疗器械应当具有唯一标识;此前已生产的第三批实施唯一标识的产品可不具有唯一标识。
然而要想实现生产、流通、使用环节的全流程闭环管理,不仅生产企业需要完成udi工作,经营企业和医疗机构端的配合也至关重要。
周军认为,理论上说唯一标识只有实现全流程闭环管理,才能发挥更大的作用。企业端只是其中的一个环节,流通环节和医院端也要联动。现在一些医院要求企业提供udi码,但不是所有地区、不是所有医院。
“医院属于卫健体系,这方面现在也在做联动,只是不同省市、不同的医院进度有差别,”陈振说,“不过多数医院都在推进udi,甚至一些医院的结算,包括医保结算,也是通过udi完成的。因为每个码是唯一的,它的编码信息也是根据产品的型号规格,通过扫码就能够直接查询到这些信息,进而完成结算,效率也比较高。”
医疗器械唯一标识生产、流通、使用环节全覆盖后,监管也将更加透明。
“以召回为例,实现全流程闭环管理后,如果有召回的情形,系统上可以直接监管产品流向,掌握企业是否全部召回。追溯方面实现信息化,理论上监管部门可以通过信息流发现问题,而不是传统的频繁现场监督。”周军谈道。
国家药监局、国家卫健委、国家医保局今年2月联合发布的《关于做好第三批实施医疗器械唯一标识工作的公告》中已经明确,医疗器械经营企业要在经营活动中积极应用唯一标识,做好带码入库、出库,实现产品在流通环节可追溯。
此外,医疗机构要在临床使用、支付收费、结算报销等临床实践中积极应用唯一标识,做好全程带码记录,实现产品在临床环节可追溯。
整体来看,医疗器械唯一标识全面铺开之势不可阻挡,新的监管时代即将到来。
(应受访者要求,陈振、周军为化名)
附件:
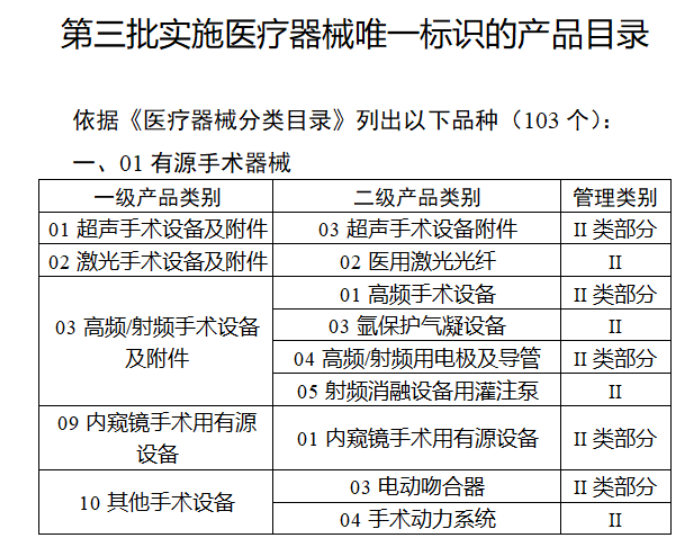
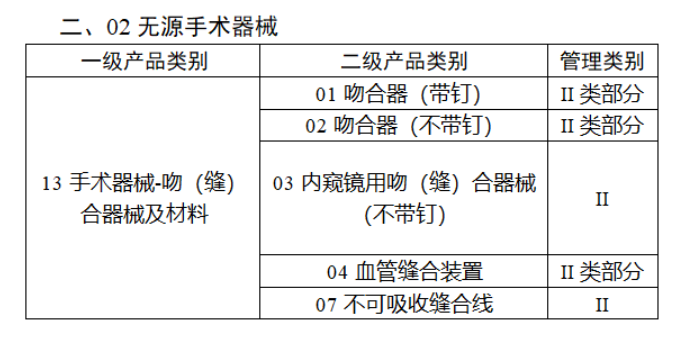
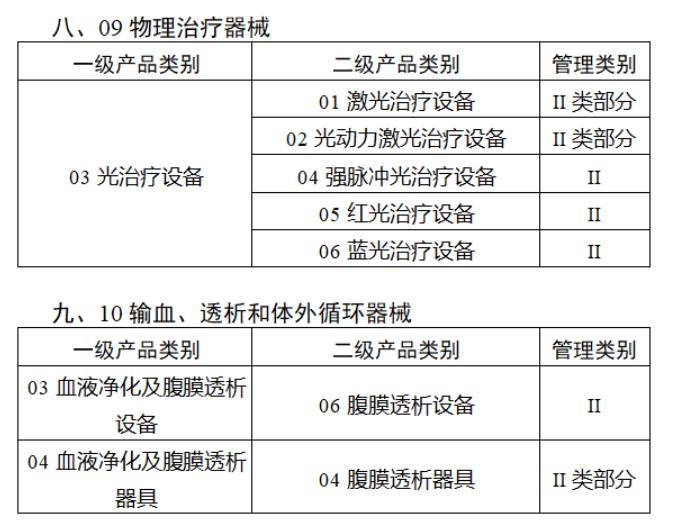
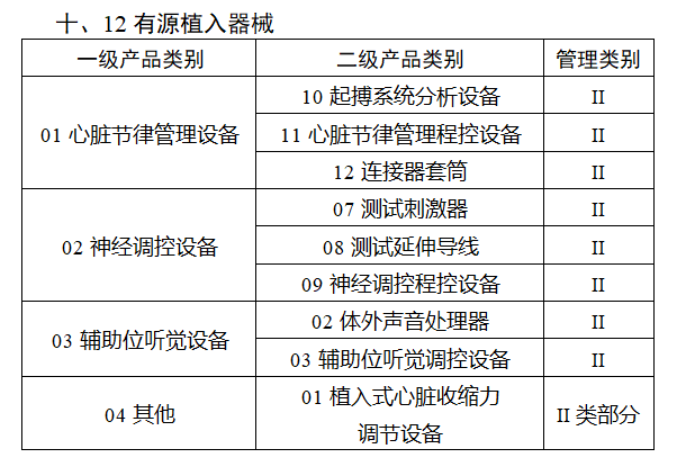
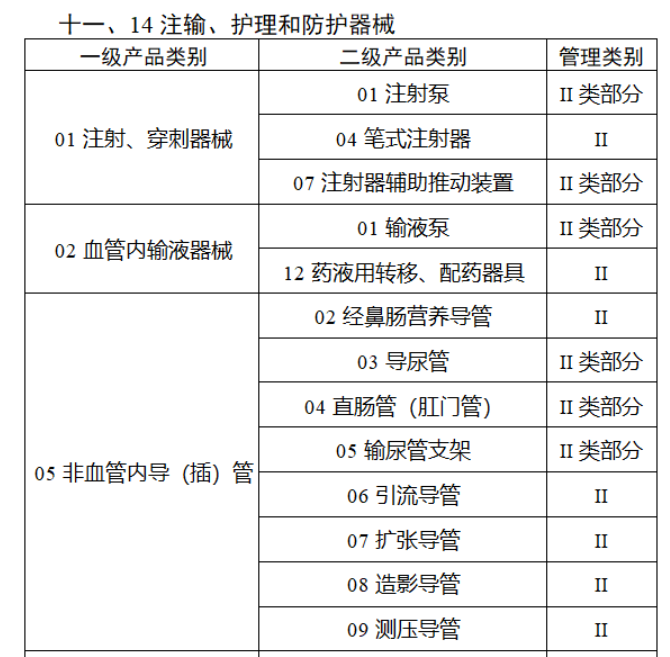
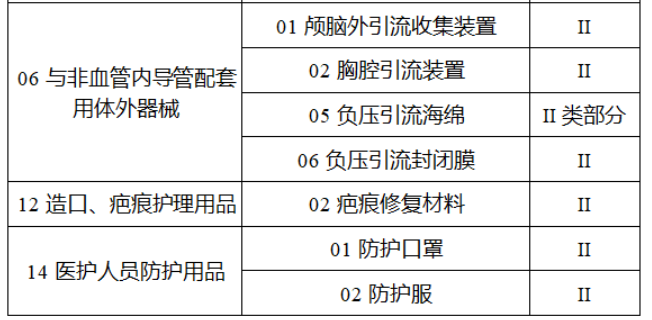
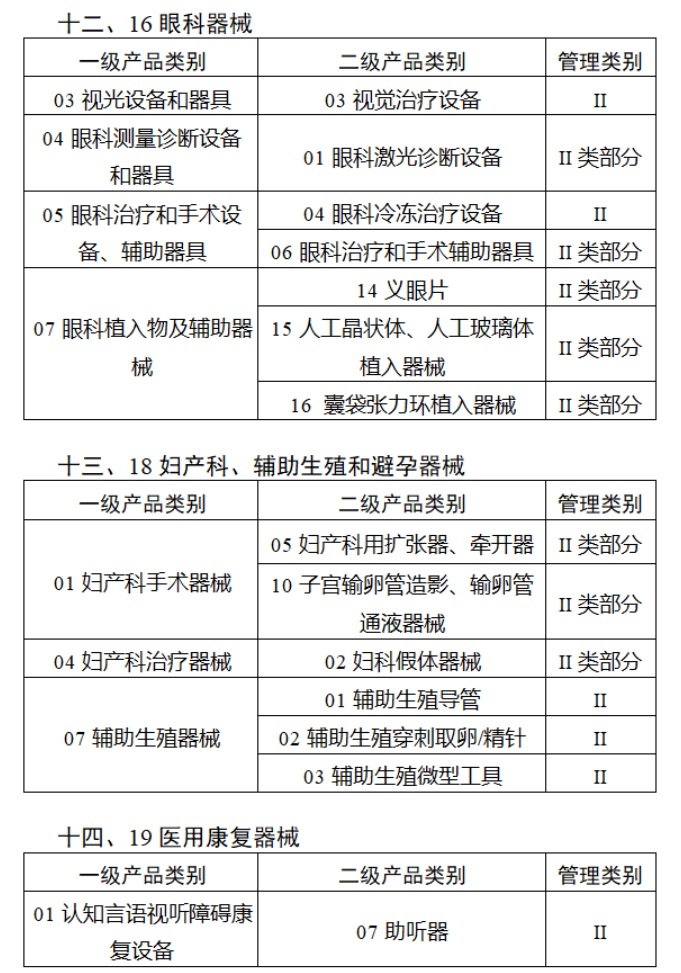
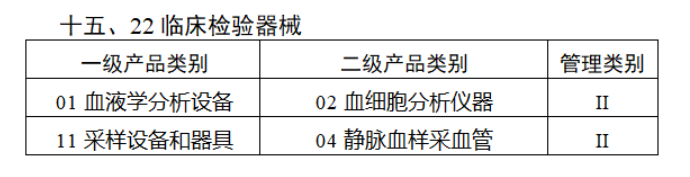
【来源:赛柏蓝器械 】

相关阅读
- 6月1日起,大批医疗器械实名制2024-06-04
- 两会代表发声,支持国产高端医疗器械2024-03-08
- 国家医保局:鼓励新技术、器械进医保2023-12-21
- 展会通知 | 2023第49届中国国际医疗器械(山东)博览会2023-09-07
- 刚刚!国家开会:鼓励创新医疗器械上市2023-07-06






