三部门发布,支持10大类创新医疗器械! -凯发k8网页登录
在带量采购背景下,具有显著临床价值的创新产品组合,将成为医疗器械企业未来发展的重要支点。政策端也在持续畅通创新器械进院渠道。
01
10类医疗器械,开展创新器械项目申报
近日,上海市经信委发布《上海市经济和信息化委员会 上海市卫生健康委员会 上海市医疗保障局 关于开展2023年上海市创新医疗器械应用示范项目申报的通知》(以下简称《通知》)。

根据《通知》,为加快生物医药创新产品应用推广,支持创新医疗器械在医疗机构开展应用示范,形成“应用示范-反馈改进-水平提升-辐射推广”的创新迭代,提高上海市创新医疗器械性能质量,推动产业高质量发展,现就开展2023年上海市创新医疗器械应用示范项目申报工作。
申报方向包括:
1.植介入器械;2.体外诊断仪器和试剂;3.医用成像器械;4.手术器械;5.治疗器械;6.诊察监护器械;7.康复器械;8.妇产科、辅助生殖器械;9.医用软件;10.其他医疗器械。
根据《通知》,由上海市医疗机构与生产企业组成“1 n 1”联合体共同申报,由1家本市医院牵头、n家本市医院/研究单位和1家本市医疗器械企业共同参与。
申报2023年上海市创新医疗器械应用示范项目的生产企业、医疗机构、研究单位需要满足一定的条件。例如,申报生产企业须为“本市注册的企业,有固定的生产和研发场地,有专职核心研发团队”,还要“企业持有项目涉及医疗器械的注册证和生产许可证,且注册证持有人与申报企业一致”。
申报应用示范创新医疗器械的产品需要满足3个条件:
(1)取得医疗器械注册证和生产许可证;(2)产品主要工作原理或者作用机理创新性较高,具有较高临床应用价值;(3)对纳入《上海市生物医药“新优药械”产品目录》《上海市创新产品推荐目录》的产品予以优先支持。

(器械目录附文末)
配套支持方面,《通知》明确,对于列入应用示范项目的创新医疗器械、参与示范项目的单位,在申报高质量发展专项、申请配置相关设施设备、申请相关收费项目和纳入医保支付时予以优先支持。在国家或本市重点项目推介、金融支持、对外合作、宣传推广等方面予以优先支持。
上述应用示范项目主要研究内容包含(根据实际情况可设置、划分子项目任务):
1.对标先进同类产品,开展临床应用数据收集与对比评价,对功能、性能、可靠性、可用性、临床应用效果、经济性等进行临床验证;2.加快实施创新医疗器械在医疗机构内临床应用,结合各自领域研究建立产品使用规范、评价指标体系;3.医疗机构提出改进建议,生产企业改进提升医疗器械质量性能并提高服务水平;4.开展使用人员培训,培养专业技术人才队伍;5.形成产医融合创新成果,加快创新医疗器械推广应用。
申报截止日期为2023年10月16日。
02
多地发文,拆解创新器械发展堵点
耗材集采全面扩围至今,较为成熟的存量市场逐一遭遇大砍价,一定程度上也倒逼企业加速创新,以更高的临床价值和优质产品换取时间窗口和议价空间。而创新医疗器械的应用推广还需支持。现如今,政策东风正在吹来。
今年以来,上海市已接连发布多个文件,明确支持创新医疗器械发展。
7月28日,上海市医保局、上海市经信委、上海市科学技术委员会、 上海市卫健委、上海市地方金融监督管理局 、国家金融监督管理总局上海监管局、上海市大数据中心等七部门联合发布《上海市进一步完善多元支付机制支持创新药械发展的若干措施》。
《措施》提出,优化新项目试行期内医疗机构自主定价机制,鼓励医疗机构加快应用。完善临床新项目备案应用机制,对首次临床应用的新项目准予收费立项后,其他医院备案后即可收费。
要加快创新药械临床应用。调整优化医疗机构考核机制,医院不得以用药目录数量、“药/耗占比”等原因限制创新药械入院。
此外,加大创新药械医保支付支持。在drg/dip支付方面对创新药械予以倾斜,提高新技术应用病例支付标准,新技术应用高倍率病例不设控制比例,成规模新技术应用可独立成组。稳步扩大本市医疗服务项目和医用耗材医保支付范围,优先覆盖创新药械。
7月10日,上海市医保局发布《上海市医用耗材纳入医保支付范围的工作规范(试行)》,其中明确,逐步将临床价值高、经济性评价优良的医用耗材纳入医保支付范围,用高质量的医疗保障水平,满足群众对新技术、新耗材的高品质医疗需求。
此外,北京市医保局2022年发布的《关于进一步完善本市新增医疗服务项目价格管理工作的通知(暂行)》中规定,属于科技重大专项、重点研发计划及创新医疗器械的产品,具有自主知识产权的创新成果转化为诊疗服务的项目,医疗机构可不受试行期限制,及时向市医保局提出优先纳入统一定价和医保支付政策评估论证程序的书面申请。
北京市医保局还在《关于印发chs-drg付费新药新技术除外支付管理办法的通知(试行)》中明确,决定试行chs-drg付费新药新技术除外支付管理办法。
创新医疗器械审批也在提速。在国新办7月5日举行的新闻发布会上,国家药品监督管理局局长焦红指出,通过这些年药品、医疗器械产品的受理量、审批量,包括今年上半年的受理量和审评量,就能够明显看出我国的药品医疗器械创新成果已经进入了爆发期。
国家药品监督管理局副局长徐景和谈到,下一步,国家药监局将持续跟踪医疗器械创新发展的新情况新进展,不断总结新经验、探索新规律、推出新举措,批准更多更好地创新高端医疗器械上市。
根据国家药监局最新数据,截至目前,国家药监局已批准228款创新医疗器械上市。国产创新医疗器械正在加速爬坡,创新竞赛还将持续上演。
附:《2023年度上海市第一批创新产品推荐目录》(器械部分)

![]()

![]()
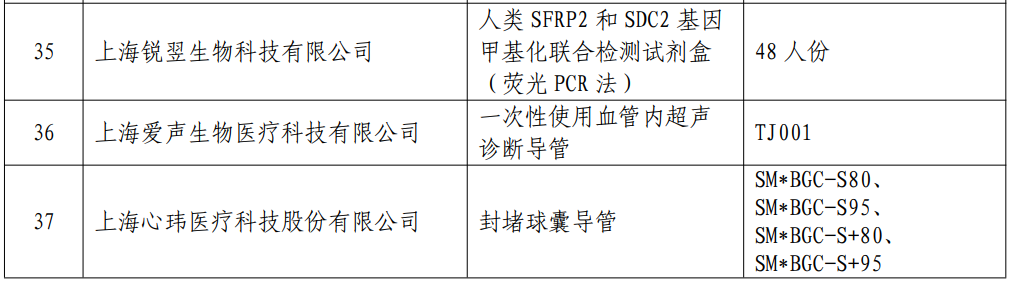

![]()
《2022年度上海市生物医药“新优药械”产品目录》(器械部分)


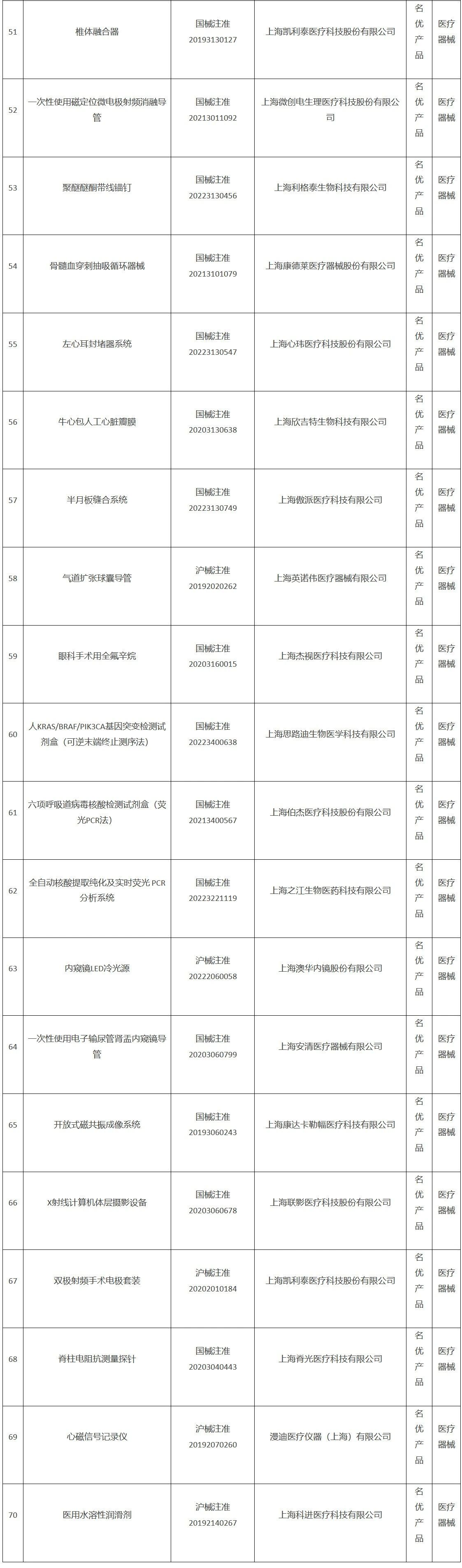








【来源:赛柏蓝器械】

相关阅读
- 医疗器械创新进入高峰期,安徽、山东、湖北…2024-12-31
- 「低国产化率」耗材不断加入,带量采购风向变了?2023-04-17
- 我国已批准156个创新医疗器械2022-05-13
- 国家药监局发布创新医疗器械特别审查程序2018-11-07
- 创新医疗器械特别审批要求及其注意事项解析2018-05-16






