8省市器械临床真实性核查进程对比 -凯发k8网页登录
2016年1月21日至22日在京召开的全国医疗器械监督管理工作会议上,总局部署了2016年医疗器械监督管理重点工作,其中提到 今年将适时启动医疗器械临床试验数据核查…

2016年2月27日,总局发布了《关于对日本富士瑞必欧株式会社的乙型肝炎病毒核心相关抗原(hbcrag)检测试剂盒不予注册的公告》(2016年第44号)。宣布此次医疗器械临床试验数据核查中首个因临床试验数据存在真实性问题而不予注册的医疗器械产品,并在通告中详细阐述了该产品临床试验数据存在的5个主要问题。
2016年6月1日,《医疗器械临床试验质量管理规范》(2016年总局令第25号)实施。总局办公厅发布通知要求各级食品药品监督管理部门对辖区内自2016年6月1日起开展的医疗器械临床试验,应严格按照新《规范》的原则及要求适时开展日常监督检查。
2016年6月8日,总局发布了《关于开展医疗器械临床试验监督抽查工作的通告》(总局通告2016年第98号)。宣布于2016年6月至10月对 在审注册申请中2016年6月1日前开展的临床试验项目(临床试验数据真实性、合规性)实施抽查,包括所有境内第三类及进口医疗器械在中国境内通过临床试验方式获取临床试验数据的注册申请项目。
2016年7月8日,国家食品药品监督管理总局发布了关于《2016年第一批医疗器械临床试验监督抽查项目》的通告(2016年第105号)公布了首批抽取的10个注册申请项目。
期间,全国已经有8个省市陆续发布了辖区内医疗器械临床试验真实性核查的通知。小编对其进行了 一下汇总(包括真实性核查的启动时间),如下表所示。
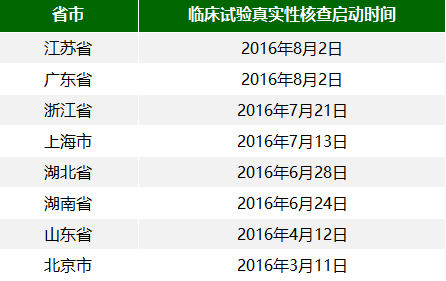
(注:山东省在2016年7月26日发布了开展医疗器械临床试验监督抽查的通知)
从 检查范围来看,各省市根据辖区内临床试验开展的情况,定义了核查的范围,目前来看的最多的要追查5年之内的临床试验项目。详细信息整理如下:
浙江省将对《规范》实施前5年的临床试验进行真实性核查,要求全省所有医疗器械注册申请人(代理人)和临床试验机构应对 2011年6月1日至2016年5月30日期间开展的临床试验项目开展自查。
北京市要求辖区内已进行医疗器械临床试验备案的单位(包括申请人、注册代理人)及 已取得医疗器械产品注册证的注册人均须按照医疗器械临床试验等相关要求,开展临床试验数据及备案情况自查,确保临床试验数据真实、可靠,原始数据保存完整。
山东省4月12日发布的通知主要是 针对省内第二类医疗器械临床试验真实性的核查。明确将山东省内未审批过的新产品,注册申请人申报的首个注册产品,治疗类仪器设备,体外诊断试剂列入核查范围。
其余省市的检查范围为:本省已进行医疗器械临床试验备案的单位(含注册代理人)且在审的医疗器械注册申请人涉及临床试验的。
从检查 日程安排来看,监督抽查将从今年夏天一直延续到冬天...
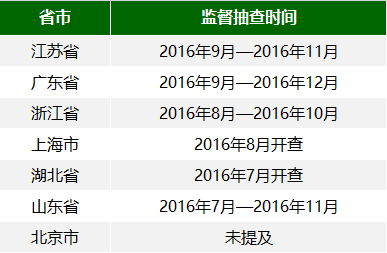
江苏省>>省局将于 2016年9月—12月对在审注册申请中2016年6月1日前开展的临床试验项目实施监督抽查, 重点抽查本省首次审批产品、生产企业首个注册产品、治疗类产品、体外诊断试剂等产品。将抽调江苏省医疗器械生产监督检查员组成检查组,对抽查的临床试验项目进行现场检查。现场检查实施前,省局将另行通知相关的临床试验机构、注册申请人以及临床试验机构和注册申请人所在地的省辖市食品药品监管局。
广东省>>将于 2016年9月—12月依据《医疗器械临床试验现场检查要点(2016年)》组织开展本省医疗器械临床试验的监督检查,对2016年6月1日前开展临床试验的在审第二类医疗器械注册申请进行抽查并公告抽查名单。我局 将在检查前三天以书面形式通知相应的临床试验机构、注册申请人。临床试验机构在广东省外的,将书面告之临床试验机构所在地的省级食品药品监督管理局。
浙江省>>将于 2016年8-10月组织检查组按照《通告》中的医疗器械临床试验现场检查程序和医疗器械临床试验现场检查要点开展监督抽查。现场检查实施前,将以书面方式通知相应的临床试验机构和注册申请人(代理人)。
上海市>>将于 2016年8月组织开展本市医疗器械临床试验核查和监督抽查。配合国家食药监总局专项检查组,按照医疗器械临床试验现场检查程序对在审注册申请中2016年6月1日前开展的临床试验项目实施抽查,包括所有境内第三类及进口医疗器械在中国境内通过临床试验方式获取临床试验数据的注册申请项目。
湖北省>>于 2016年7月中旬组织开展医疗器械临床试验监督抽查。
山东省>>将于 2016年7月-11月分期分批组成检查组开展现场检查。现场检查实施前,将以书面形式通知相应的临床试验机构、注册申请人以及临床试验机构和注册申请人所在地的市级食品药品监督管理局。
对山东省食品药品监管局 在审第二类医疗器械注册申请中2016年6月1日前开展的临床试验项目实施监督抽查。 重点抽查本省以前未审批过的产品、生产企业首个注册产品、治疗类产品、诊断类产品和体外诊断试剂等,抽查重点和比例按照《山东省食品药品监督管理局关于开展第二类医疗器械临床试验真实性核查的通知》有关规定执行。其他产品综合考虑其 风险程度、申请量比例、申请人情况、临床试验机构规模和承担项目数量等因素,按照一定比例抽取。
【来源:cmdra】

相关阅读
- 3械企被罚,问题出在这(附图文)2020-07-20
- 全面加强疫情防控医疗器械的质量监管2020-04-29
- 2019年医疗器械监管重点工作备忘录2019-01-29
- 《医疗器械不良事件监测和再评价管理办法》发布2018-09-03
- 各省又有新规定,医疗器械监管呈高压态势!2018-06-13






