刚刚!国家药监局:医疗器械编码日期、品种正式发布 -凯发k8网页登录
10月15日正式稿发布(9月17征求意见稿),执行日期与部分内容都做了修订,医疗器械编码的通知正式下发。
工作进度安排下发
今日下午(10月15日),国家药监局凯发k8天生赢家一触即发官网发布通知,《关于做好第一批实施医疗器械唯一标识工作有关事项的通告》正式发布。

此前,国家药监局发布了该要求的征求意见稿,经修订后,确定后的《通告》对第一批医疗器械唯一标识实施品种范围、进度安排、工作要求等进行了明确规定。
需要注意的是,执行日期也做了重要变更。
分步推行医疗器械唯一标识制度
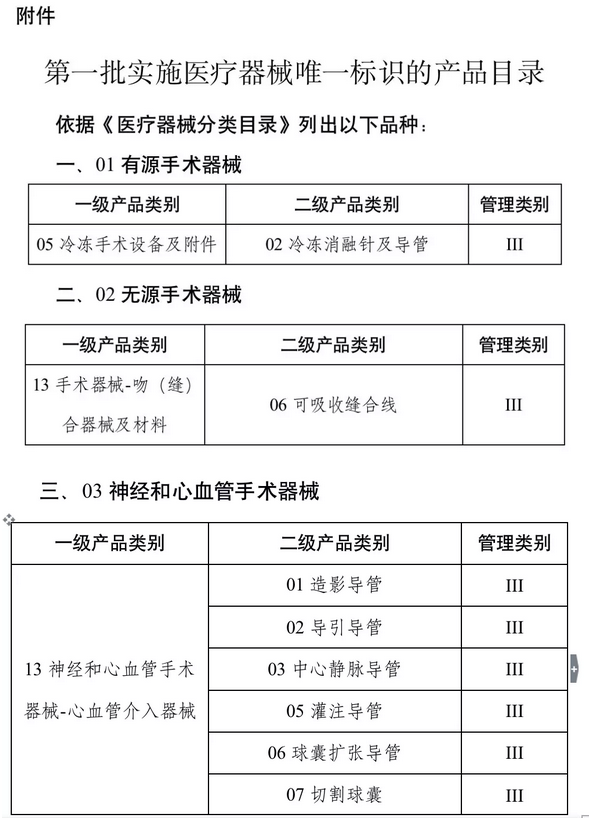
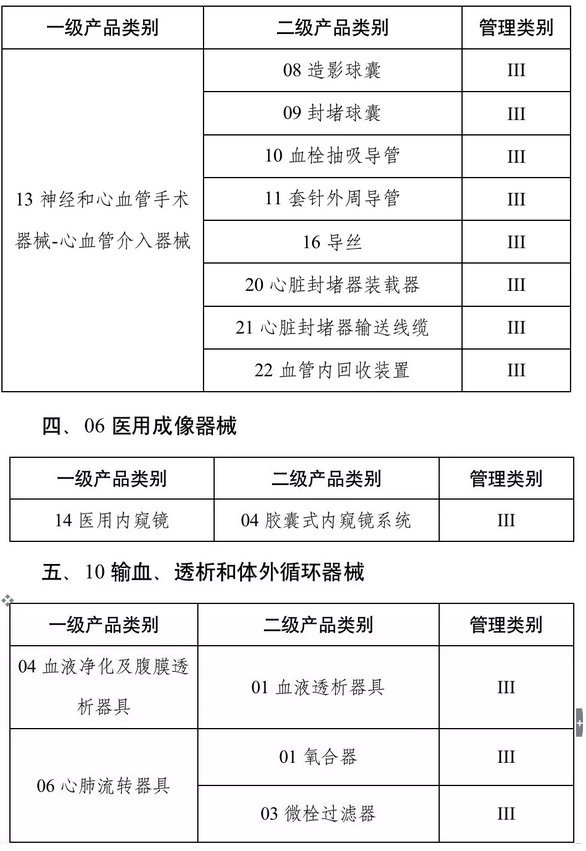
品种范围上:按照风险程度和监管需要,确定部分有源植入类、无源植入类等高风险第三类医疗器械作为第一批医疗器械唯一标识实施品种。
心脏起搏器、髋关节假体、整形用注射填充物等九大类64个品种被列入第一批实施医疗器械唯一标识的产品目录,(具体产品目录文末见附件)。
进度安排是:
征求意见稿的日期规定是2020年8月,正式版延后2个月。
对列入第一批实施产品目录的医疗器械,注册人应当按照时限要求有序开展以下工作:
(一)唯一标识赋码
2020年10月1日起,生产的医疗器械应当具有医疗器械唯一标识;
2020年10月1日前已生产的医疗器械可不具有医疗器械唯一标识。生产日期以医疗器械标签为准。
(二)唯一标识注册系统提交
2020年10月1日起,申请首次注册、延续注册或者注册变更时,注册申请人/注册人应当在注册管理系统中提交其最小销售单元的产品标识。
产品标识不属于注册审查事项,产品标识的单独变化不属于注册变更范畴。
(三)唯一标识数据库提交
2020年10月1日起生产的医疗器械,在其上市销售前,注册人应当按照相关标准或者规范要求将最小销售单元、更高级别包装的产品标识和相关数据上传至医疗器械唯一标识数据库;
当医疗器械产品最小销售单元产品标识的相关数据发生变化时,注册人应当在该产品上市销售前,在医疗器械唯一标识数据库中进行变更,实现数据更新。
医疗器械最小销售单元产品标识变化时,应当按照新增产品标识上传数据至医疗器械唯一标识数据库。
械企应该怎么做
对于企业来说,第一批实施唯一标识工作的注册人应当高度重视,充分认识《规则》实行的重要意义,严格按照《规则》和本通告要求组织开展赋码、数据上传和维护等工作,并对数据真实性、准确性、完整性负责。
对于注册人的要求是,鼓励注册人应用医疗器械唯一标识建立医疗器械信息化追溯系统,实现对其产品生产、流通、使用全程可追溯。
鼓励医疗器械生产经营企业、使用单位在其相关管理活动中积极应用医疗器械唯一标识,探索建立与上下游的追溯链条,推动衔接应用。
应开展《规则》培训工作,对注册人、生产经营企业、使用单位等开展有针对性的业务培训,组织有关人员学习,加强工作指导和实施。
系统和唯一标识有什么作用
根据8月27日,国家药监局发布《医疗器械唯一标识系统规则》称,医疗器械唯一标识系统:由医疗器械唯一标识、唯一标识数据载体和唯一标识数据库组成。
医疗器械唯一标识,是指在医疗器械产品或者包装上附载的,由数字、字母或者符号组成的代码,用于对医疗器械进行唯一性识别。
医疗器械唯一标识数据载体,是指存储或者传输医疗器械唯一标识的数据媒介。
医疗器械唯一标识数据库,是指储存医疗器械唯一标识的产品标识与关联信息的数据库。
其中,医疗器械唯一标识包括产品标识和生产标识。
产品标识为识别注册人/备案人、医疗器械型号规格和包装的唯一代码;生产标识由医疗器械生产过程相关信息的代码组成,根据监管和实际应用需求,可包含医疗器械序列号、生产批号、生产日期、失效日期等。
同时,《规则》要求医疗器械唯一标识应当符合唯一性、稳定性和可扩展性的要求。
唯一性,是指医疗器械唯一标识应当与医疗器械识别要求相一致。
稳定性,是指医疗器械唯一标识应当与产品基本特征相关,产品的基本特征未变化的,产品标识应当保持不变。
可扩展性,是指医疗器械唯一标识应当与监管要求和实际应用不断发展相适应。
此外,医疗器械唯一标识数据载体应当满足自动识别和数据采集技术以及人工识读的要求。如空间有限或者使用受限,应当优先采用符合自动识别和数据采集技术的载体形式。
自动识别和数据采集技术包括一维码、二维码或者射频标签等形式,鼓励采用先进的自动识别和数据采集技术。
采用一维码时,可将产品标识和生产标识串联,也可多行并联;采用射频标签时,应当同时具备一维码或者二维码。
确定版:第一批产品目录



【来源:国家药监局 / 赛柏蓝器械 作者:米克】

上一篇:一批三甲医院供应商,或被砍






