2017年飞检开始 6省6家医疗器械企业已被查 -凯发k8网页登录
发布时间:2017/4/12 13:34:05
由国家药监总局组织的2017年度医疗器械飞行检查工作已经开始了。
4月11日,药监总局通报了对6家医疗器械生产企业的飞行检查情况,检查时间均在今年3月底,受查企业分布在6个不同省份,其中5家为ivd企业,1家为无菌医疗器械生产企业,所查均为医械gmp合规情况,检查结果则均为限期整改。
另外,今年2月27日时,药监总局食品药品审核查验中心才发布公告,称经过综合考评后聘任45人为第二批国家医疗器械检查员。而从4月11日的通报来看,第二批国家检察员已经行动了,部分人早已参与到3月底的飞行检查工作中。
再按照此前披露消息,今年药监总局一共计划本级飞检50-80家械企,包括两类:高风险产品生产企业;由总局直接办理案件中涉及的生产企业。除了已经被查的6家企业,接下来,还有几十家企业也将迎来总局飞检了。
以下为今年率先被查的6家企业各自问题情况:
1、浙江东瓯诊断产品有限公司
产品类别:体外诊断试剂
主要缺陷和问题:



2、云南德华生物药业有限公司
产品类别:无菌医疗器械
主要缺陷和问题:



3、同昕生物技术(北京)有限公司
产品类别:体外诊断试剂
主要缺陷和问题:



4、上海之江生物科技股份有限公司
产品类别:体外诊断试剂
主要缺陷和问题:



5、山东三月三基因技术有限公司
产品类别:体外诊断试剂
主要缺陷和问题:
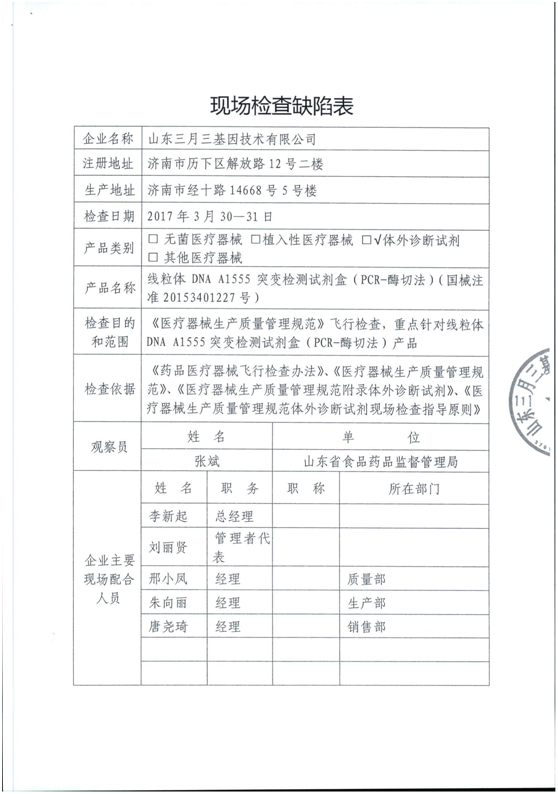



6、湖北朗德医疗科技有限公司
产品类别:体外诊断试剂
主要缺陷和问题:
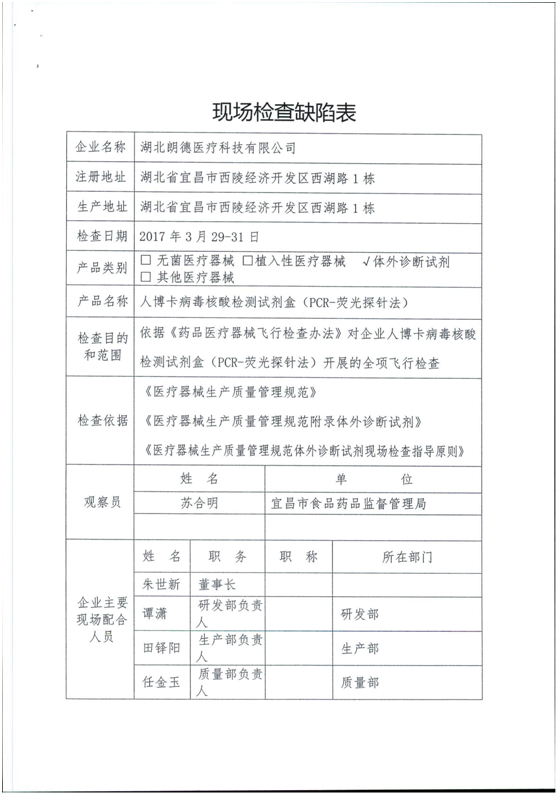


【来源:国家食品药品监督管理总局】

相关阅读
- 食品药品监管总局发布《药品医疗器械飞行检查办法》2015-07-09






