国家医疗器械不良事件监测年度报告(2015年) -凯发k8网页登录
一、全国医疗器械不良事件报告总体情况
2015年,全国医疗器械不良事件监测工作继续稳步发展,全年可疑医疗器械不良事件报告数已超过32万份。在报告数量持续增长的同时,报告质量也不断提升,为医疗器械上市后风险的分析与评价提供了依据。
(一)2015年全国可疑不良事件报告总体情况
2015年,国家药品不良反应监测中心共收到《可疑医疗器械不良事件报告表》321,254份,比2014年增长了21.1%。2002年 1月1日至2015年12月31日,国家药品不良反应监测中心累计收到《可疑医疗器械不良事件报告表》1,322,059份(图1-1)。
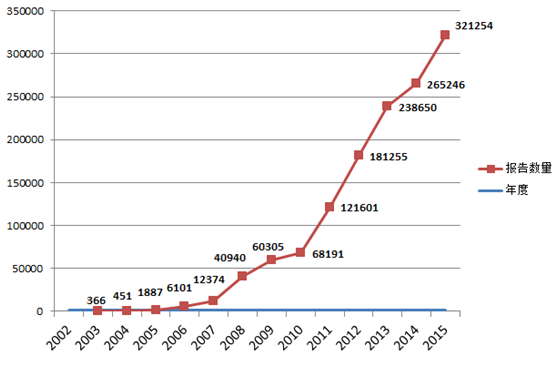
图1-1 2002-2015年全国可疑医疗器械不良事件报告数量
1、死亡及严重伤害可疑不良事件报告数量
2015年,国家药品不良反应监测中心共收到死亡可疑不良事件报告184份,严重伤害可疑不良事件报告47,065份,共计47,249 份,比2014年增长了15.2%(图1-2)。2015年死亡及严重伤害可疑不良事件报告数量占报告总数的比例为14.7%,比2014年下降了 0.8%。
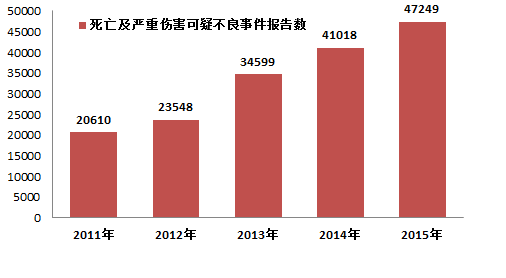
图1-2 2011-2015年全国死亡及严重伤害可疑不良事件报告数比较
2、每百万人口平均报告数量
2015年,我国每百万人口平均可疑医疗器械不良事件报告数为240份,与2014年相比增长了42份(图1-3)。
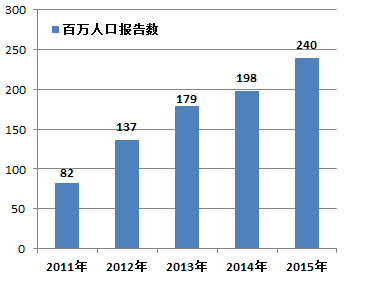
图1-3 2011-2015年全国每百万人口平均报告数比较
3、注册基层用户数量
截止2015年12月31日,在全国医疗器械不良事件监测系统中,注册基层用户(包括医疗器械生产企业、经营企业和使用单位)共198, 536家。其中,医疗器械生产企业10,344家,占注册基层用户总数的5.2%;经营企业91,322家,占注册基层用户的46.0%;使用单位96,870家,占注册基层用户的48.8%(图1-4)。
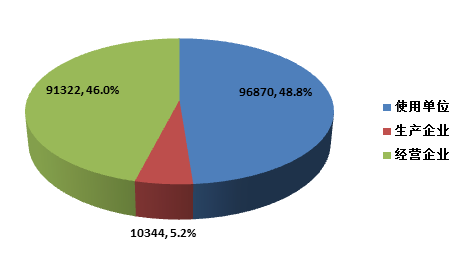
图1-4 2015年全国医疗器械不良事件监测系统注册基层用户情况
2015年,注册基层用户(包括医疗器械生产企业、经营企业和使用单位)总数比2014年增长了13.9%。其中,医疗器械生产企业、经营企业和使用单位的注册基层用户分别比2014年增长了11.8%、21.8%和7.5%(图1-5)。
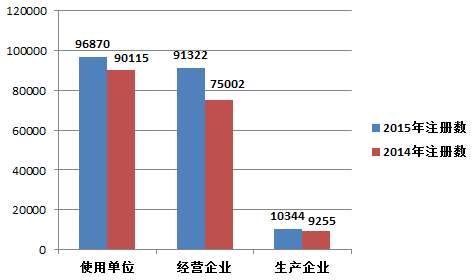
图1-5 2014年和2015年全国注册基层用户分类比较情况
二、2015年医疗器械不良事件报告统计分析
(一)按报告来源统计分析
2015年,全国上报的可疑医疗器械不良事件报告中,使用单位上报259,219份,占总报告数的80.6%;生产企业上报5,352份,占总报告数的1.7%;经营企业上报56,315份,占总报告数的17.5%;还有364份报告来自于个人,占总报告数的0.1%;此外还有4份报告来源不详(图2-1)。
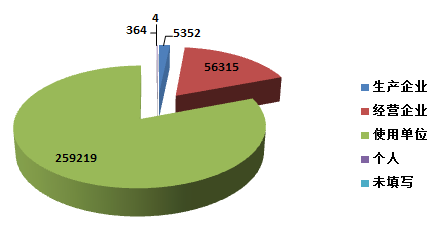
图2-1 2015年医疗器械不良事件报告来源情况
总体来看,不良事件报告仍主要来源于使用单位。相比2014年,生产企业提交的报告所占比例有所下降,与其器械使用安全第一责任人的地位不符,其履行职责的自觉性有待提高。
(二)按事件伤害程度统计分析
2015年,全国上报的可疑医疗器械不良事件报告中,事件伤害为死亡的报告共184份,占总报告数的0.05%;事件为严重伤害的报告共 47,065份,占总报告数的14.7%;事件伤害为其他的报告共274,005份,占总报告数的85.2%(图2-2)。2015年,各类伤害程度的报告绝对数量均有所增加,其所占比例与2014年相似。
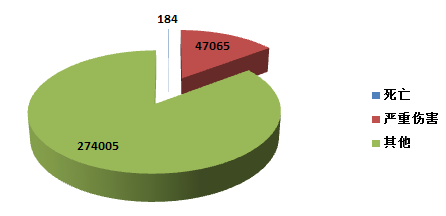
图2-2 2015年医疗器械不良事件报告事件伤害程度情况
(三)按医疗器械管理类别统计分析
2015年,全国上报的可疑医疗器械不良事件报告中,涉及ⅲ类医疗器械的报告133,548份,占总报告数的41.6%;涉及ⅱ类医疗器械的报告126,284份,占总报告数的39.3%;涉及ⅰ类医疗器械的报告50,213份,占总报告数的15.6%;部分报告涉及的器械管理类别不详,共 11,209份,占总报告数的3.5%。数据显示,涉及ⅲ类和ⅱ类医疗器械的报告占绝大多数,这与医疗器械风险程度高低相吻合(图2-3)。
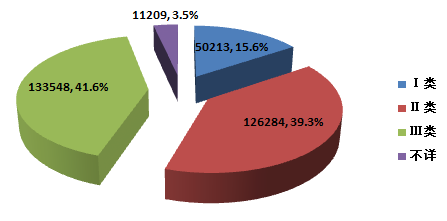
图2-3 2015年医疗器械不良事件报告涉及产品管理类别情况
(四)按医疗器械分类目录统计分析
按照现行的《医疗器械分类目录》,2015年全国上报的可疑医疗器械不良事件报告共涉及43类产品,涵盖了《医疗器械分类目录》中的所有医疗器械类别。其中,报告数量位列前十位的产品类别见表2-1。与2014年相比,报告数量排名前十位的产品类别没有变化,仅部分产品类别的排名略有变化。
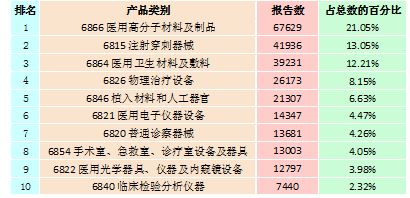
表2-1 2015年医疗器械不良事件报告数量排名前十位的产品类别情况
(五)按医疗器械产品名称统计分析
2015年,全国上报的可疑医疗器械不良事件报告中,报告数量排名前十位的无源医疗器械分别为一次性使用输液器、一次性使用无菌注射器、宫内节育器、静脉留置针、角膜接触镜、玻璃体温计、导尿包、医用胶带、普通血压计和导尿管,占总报告数的36.45%,详见表2-2。
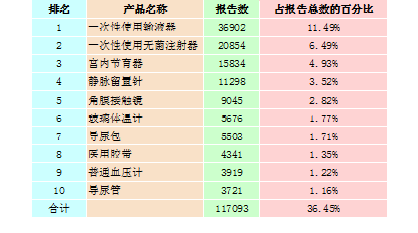
表2-2 报告数量排名前十位的无源医疗器械
2015年,全国上报的可疑医疗器械不良事件报告中,报告数量排名前十位的有源医疗器械分别为病人监护仪、输液泵和注射泵、电子血压计、血液透析机、心电图机、血糖仪、呼吸机、电子体温计、婴儿培养箱和微波治疗机,占总报告数的7.23%,详见表2-3。
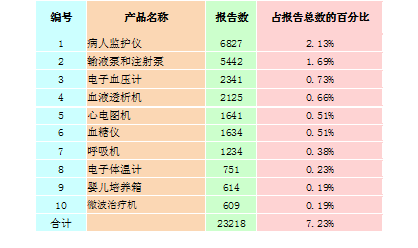
表2-3 报告数量排名前十位的有源医疗器械
(六)按涉及实际使用场所统计分析
2015年,全国上报的可疑医疗器械不良事件报告中,使用场所为“医疗机构”的报告232,641份,占72.4%;使用场所为“家庭”的报告39,632份,占12.3%;使用场所为“其他”的报告8,438份,占2.6%;使用场所未填写的报告40,543份,占12.6%(图 2-4)。使用场所的复杂性是分析不良事件发生原因时需要考量的因素之一。
三、2015年医疗器械风险评价及采取的主要措施情况
(一)发布《医疗器械不良事件信息通报》
2015年,总局共发布3期《医疗器械不良事件信息通报》,涉及医用血管造影x射线机、体外除颤器和低频电磁治疗设备三类产品。
医用血管造影x射线机的临床使用风险主要表现为造影机故障。这些故障主要包括无射线,设备无法启动、死机、自动关机,图像不清晰,图像不能保存,机架臂无法锁死,手术床无法移动等。其中以球管和操作台的故障报告最多。为减少不良事件重复发生造成伤害的风险,建议生产企业在产品设计中,增加对易老化、易损耗部件状态的监测,必要时增加报警信息,以便于使用者及时识别;加强对医疗机构的使用培训,包括设备的操作规程、运行环境要求、易损件的使用寿命等。建议医疗机构详细阅读设备使用说明书,熟悉操作规程和使用注意事项,严格按照使用说明书的要求保证设备运行环境。
体外除颤器临床使用风险主要表现为:心脏除颤功能失效、监视器或记录器失效或受扰紊乱。为减少不良事件重复发生造成伤害的风险,提醒使用单位根据相关国家标准和行业标准,及所使用体外除颤器的随机文件要求,建立并严格执行体外除颤器的日常维护机制;生产企业应考虑除颤器的特殊性(高风险、不常使用),尽量通过“机宜人”的设计使产品易于维护,并且加强关键部件的可靠性设计,以减少设备故障的发生。
低频电磁治疗设备临床使用风险主要以电能危害为主,其中人员伤害的主要表现为皮肤过敏、烫伤、灼伤、刺痛、疼痛及肌肉麻木等;器械故障的主要表现有:漏电,无输出或输出不稳定,电极片、导联线损坏等。为加强低频电磁治疗设备的安全使用,减少不良事件的发生,提醒使用者:1.严格控制适应症及禁忌症,按照产品使用说明书正确使用,切勿超输出功率、超时长等非正常使用,确保设备的使用环境和使用条件符合要求;2.加强设备的日常检查和维护保养,及时更换易损、易耗件。
(二)发布《医疗器械警戒快讯》
2015年,国家药品不良反应监测中心共发布9期《医疗器械警戒快讯》,包括52条国外医疗器械监管机构发布的安全性信息,涉及血管内回收钳、麻醉呼吸回路、除颤器、胰岛素泵、呼吸机、人工晶体等产品。

相关阅读
- 总局发布2016年第8期国家医疗器械质量公告2016-10-26
- 北京市医疗器械审批流程简化2016-08-15
- 为期4个月,械企械商医院同受检,2类医械迎全国大检查!2016-08-15
- 浙江医械产品注册将收费 比肩京沪2016-08-10
- 总局发布2015年医疗器械不良事件监测年度报告2016-05-31






